ANODIZAÇÃO
– EMBASAMENTO TEÓRICO
A anodização é um
processo eletroquímico que consiste na deposição de uma camada de óxido sobre
uma superfície metálica, e tem o intuito de, por exemplo, proteger o metal
anodizado do processo de corrosão, além de conferir um acabamento estético
atrativo, pois a camada de óxido é receptível à aplicação de tintas e corantes
(Aroeira, Gustavo, 2006). É sabido que em metais ferrosos, a formação de
camadas de óxido sobre suas superfícies é chamada ferrugem, e é prejudicial ao
material, pois deteriora o mesmo. Contudo, em metais como ligas de alumínio, a
formação de uma camada de óxido pode atuar como uma proteção.
A realização da
anodização de uma peça metálica, como uma liga de alumínio, ocorre através de
uma eletrólise, que é, basicamente, um método eletroquímico não espontâneo de
gerar determinados produtos através de uma reação de oxirredução, proveniente
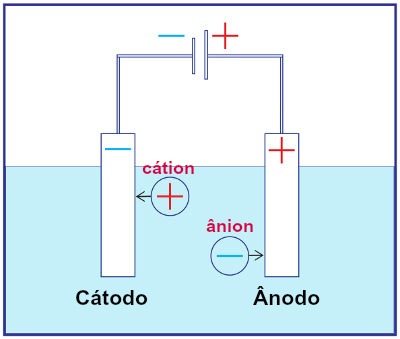
de uma corrente elétrica. Na eletrólise, um íon positivo (cátion) sofre uma
redução (ganho de elétrons) no cátodo (polo negativo), enquanto um íon negativo
(ânion) sofre oxidação (perda de elétrons) no ânodo (polo positivo) (DIAS, Diogo Lopes, 2016). Uma
representação esquemática de um sistema eletrolítico encontra-se na figura 1:
Figura 1 – Representação da
montagem de um sistema eletrolítico qualquer
Fonte: Brasil Escola
Existem 2 tipos
distintos de eletrólise: ígnea e aquosa. A principal característica da
eletrólise ígnea, é a sua elevada temperatura para fundir um composto iônico,
enquanto a principal característica da eletrólise aquosa, é que a mesma ocorre
partindo da dissociação de um composto iônico através da imersão do mesmo em
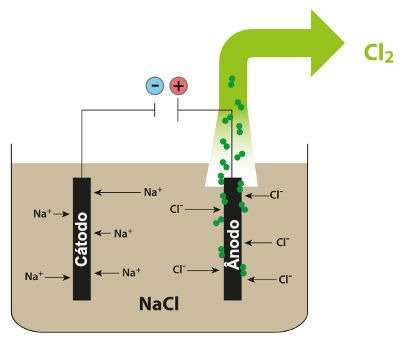
água. Um exemplo de eletrólise ígnea, é a sua aplicação no cloreto de sódio,
com o intuito de obter sódio metálico e gás cloro: inicialmente, ocorre a
dissociação do cloreto de sódio através de uma pirólise, a uma temperatura
alta, pois compostos iônicos possuem elevados pontos de fusão (DIAS, Diogo Lopes, 2016).
NaCl(s) à Na+(l) + Cl-(l)
Posteriormente à
formação dos íons, ativa-se uma diferença de potencial no sistema, através de
uma pilha, fazendo com que o cátion Na+ vá para o cátodo, e o ânion
Cl- vá para o ânodo. Como citado anteriormente, o ânion sofre uma
oxidação no ânodo, e o cátion sofre uma redução no cátodo, segundo as seguintes
equações (DIAS, Diogo Lopes, 2016).
2
Cl- (l) à 2 e- + Cl2 (g) (ocorre no ânodo)
Na+(l)
+ e à Na (s) (ocorre no cátodo)
Por fim, obteve-se os
dois elementos químicos constituintes do cloreto de sódio: o sódio e o cloro
(na forma de gás cloro). Uma representação esquemática do processo supracitado
encontra-se na figura 2 (DIAS, Diogo
Lopes, 2016).
Figura 2 – Esquema demonstrando a
eletrólise ígnea do NaCl
Fonte:
Brasil Escola
Para compreender a
eletrólise aquosa, tomemos como
exemplo a sua aplicação ao cloreto de sódio: O primeiro passo para este
processo, é realizar a dissociação do composto iônico através da imersão do
mesmo em água:
NaCl
(s) + H2O (l) à Na+(aq) + Cl-
(aq)
Ademais, há também a autoionização da água, segundo
a seguinte equação química:
H2O
(l) à H+(aq) + OH-(aq)
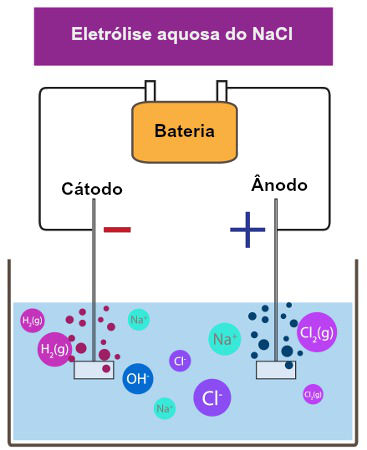
Portanto, tem-se em
solução os cátions Na+ e H+, e os ânions Cl- e
OH-. O passo seguinte é aplicar uma diferença de potencial ao
sistema, e observar o movimento do cátion H+ em direção ao cátodo, e
o movimento do íon cloreto em direção ao ânodo. O cloreto irá sofrer uma
oxidação no ânodo, ocasionando a formação de gás cloro, enquanto que o H+
sofrerá uma redução no cátodo, formando hidrogênio molecular, processos estes,
representados pelas seguintes equações químicas (DIAS, Diogo Lopes, 2016).
2
Cl- (l) à 2 e- + Cl2 (g) (ocorre no ânodo)
2
H+(aq) + 2 e- à H2 (g) (ocorre no
cátodo)
Como produto secundário
da eletrólise aquosa do cloreto de sódio, há o hidróxido de sódio
(comercialmente conhecido como soda cáustica), pois o íon hidróxido em solução
reage com o íon sódio que também está em solução originando o NaOH. Dito isso,
é possível escrever a equação global do processo citado (DIAS, Diogo Lopes, 2016).
2
NaCl(aq) + 2 H2O(l) à
1 H2(g) + 1 Cl2(g) + 2 NaOH(aq)
Figura 3 – Esquema demonstrando a
eletrólise aquosa do NaCl
Fonte: Brasil Escola
Conhecendo-se o processo de eletrólise, é possível
então compreender como funciona a teoria de uma anodização de uma peça
metálica.
Na anodização de uma
peça metálica, a mesma é colocada em um banho eletrolítico de modo a atuar como
o ânodo da eletrólise. O cátodo do sistema deve ser um material que apresente
passividade nas condições do banho eletrolítico. A passividade pode ser
entendida como a perda da reatividade química em determinadas condições, e é
apresentado por alguns metais, tais como: cromo, ferro, níquel e titânio. É
provável que tal comportamento passivo seja resultado da formação de uma camada
de óxido muito aderente sobre a superfície do metal (CALLISTER, 2002). O chumbo
é um bom cátodo para uma anodização que utilize ácido sulfúrico como parte do
banho eletrolítico, visto que, o chumbo, na presença de H2SO4,
é coberto por uma fina camada de sulfato de chumbo (PbSO4), o que o
torna inerte em relação ao banho eletrolítico (pode-se dizer, portanto, que o
chumbo foi passivado, nas condições supracitadas) (Marins, Laura, 2012). O
banho eletrolítico feito de uma solução de ácido sulfúrico deve ter título
variando de 10% até 20% (m/m). Ao
ativar-se a fonte de DDP (uma pilha, por exemplo), uma corrente elétrica começa
a fluir no sistema eletrolítico. Tal corrente deve ser de aproximadamente 1,5 A
para cada dm2 de área superficial do material a ser anodizado, visto
que, em casos de correntes muito elevadas, é possível que a peça a ser
anodizada sofra queimaduras. (Marins, Laura, 2012). Durante o processo de anodização, ocorre uma
oxidação no ânodo, ou seja, os elétrons da peça metálica são retirados da
mesma, ocasionando a formação de íons. Tais íons reagem com a água do banho
eletrolítico, formando uma camada de óxido sobre o metal (Aroeira, Gustavo,
2006). Quimicamente, óxidos são compostos binários formados por oxigênio e um
outro elemento químico, onde o oxigênio é o átomo mais eletronegativo. (SOUZA,
Líria Alves de.) A formação do óxido de alumínio ocorre por meio de uma reação
de síntese, ou seja, mais de um reagente gerando apenas um produto. Consiste,
portanto na seguinte equação química:
Al
3+ + O 2- à Al2O3
De maneira geral,
existem dois tipos distintos de anodização: aquela que gera uma camada ‘’contínua’’
de óxido, e aquela que gera uma camada porosa de óxido sobre o metal anodizado.
O segundo tipo de anodização é mais aplicável ao alumínio. O que faz com que um
dado processo de anodização resulte em um determinado tipo de camada
(‘’contínua’’ ou porosa) é o potencial hidrogeniônico (pH) do banho
eletrolítico. A camada ‘’contínua’’ de óxido se forma em casos de pH
aproximadamente iguais a 7, enquanto que a camada porosa se forma quando o pH
do banho eletrolítico é menor do que 7, pois assim, o meio encontra-se com uma
maior concentração de íon hidroxônio (é (mais ácido), fazendo com que a camada
de óxido se dissolva, gerando os poros. (Aroeira, Gustavo, 2006). Em caso de
anodizações que gerem camadas porosas de óxido, é necessário realizar um fechamento
dos mesmos (selagem). Esse processo é feito ao colocar a peça metálica
anodizada em contato com água quente, o que resulta na formação de um óxido
hidratado. No caso de uma peça de alumínio, por exemplo, a sua anodização gera
uma camada de alumina (Al2O3) revestindo-o. Ao colocar o
alumínio anodizado (alumínio com uma camada de alumina) em contato com água
quente, ocorre a formação de Al2O3. n H2O
(óxido hidratado). Este óxido hidratado tem uma densidade menor do que a
densidade da alumina, logo, possui maior volume. Com isso, a alumina hidratada preenche
os poros (pois ocupa um espaço maior, em comparação ao óxido de alumínio não
hidratado), fechando-os (Marins, Laura, 2012). Vide figuras 4 e 5 para
visualização esquemática dos dois tipos de camadas de óxido sobre uma
superfície metálica.
Figura 4 – Camada ‘’contínua’’
de óxido sobre uma peça metálica
Fonte: Wikipédia na página de oxidação
Figura 5 – Camada porosa de
óxido sobre uma peça metálica
Fonte: Wikipédia na página de Oxidação
Por: Marcelo Coelho
REFERÊNCIAS
CALLISTER, William. Ciência e engenharia de materiais:
uma introdução. 6° edição. LTC 2002
MARTINS, L. Anodização
e coloração de peças de alumínio. Universidade do Porto, FEUP/DEEC, 2002. Disponível
em: < http://repositorio.up.pt/>